Class 9 Science Chapter 3 | Class 9 Science Chapter 3 Question Answer | Class 9 Science Chapter 3 Jac Board Solution | परमाणु और अणु
सभी अध्यायों के लिए विज्ञान NCERT पुस्तक समाधान Smart Classes के Teachers और Experts के द्वारा बिलकुल आपकी भाषा में तैयार किया गया है | ताकि आप समाधान को समझ सके और आसानी से याद कर सके |
class 9 science chapter 3 परमाणु एंव अणु
Hindi Medium के लिए कक्षा 9 विज्ञान NCERT समाधान जो की NCERT पुस्तक समाधान नवीनतम CBSE, JACऔर NCERT पाठ्यक्रम पर आधारित है | NCERT पुस्तक समाधान हर साल Smart Classes के द्वारा Update किया जाते है | इसलिए कक्षा 9 के लिए NCERT पुस्तक समाधान भी Smart Classes के द्वारा वर्ष 2022 – 23 के लिए Update किया गया है |
Jac Board Solution Class 9 Science Chapter 3 . Hindi Medium के छात्रों के लिए Hindi में कक्षा 9 विज्ञान NCERT पुस्तक समाधान के सभी अध्याय नवीनतम CBSE, JAC और NCERT पाठ्यक्रम पर आधारित है |
Jac Board Solutions Class 9 Science Chapter 3:परमाणु एंव अणु
Tw Smart Classe , students, teachers, & tutors के requirments के मुताबिक सभी study materials तैयार करती है | हमारे द्वारा और भी study materials तैयार किये जाते है |
हमारे द्वारा तैयार किये गए ncert book solution कुछ इस तरह रहेगी >>
- नोट्स
- अभ्यास
class 9 science chapter 3 परमाणु एंव अणु
अध्याय 3 :परमाणु एंव अणु (Atoms and Molecules )
♦ परमाणु :- परमाणु किसी तत्व का सूक्ष्मतम कण हे,जिसे हमलोग ओर विभाजित नही कर सकते उसे परमाणु कहते है |
उदहारण:-हाइड्रोजन (H), नियॉन (Ne), आर्गन (Ar), लोहा (Fe), कैल्शियम (Ca).
♦ अणु :- परमाणुएँ आपस में मिलकर अणु का निर्माण करती है
उदाहरण:-H2 और CO
♦ आण्विक द्रव्यमान :- किसी पदार्थ का आण्विक द्रव्यमान उसके सभी संघटक परमाणुओं के द्रव्यमान का योग होता है |
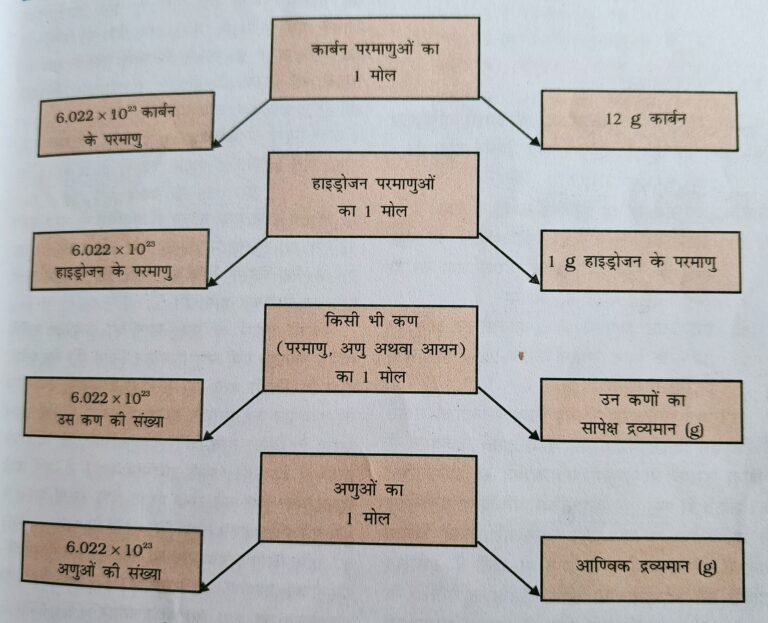
♦ मोल :- मोल पदार्थ की वो मात्रा है जिसमे कणों की संख्या ( परमाणु, आयन ,अणु या सूत्र इकाई ) कार्बन -12 के ठीक 12 g में विधमान परमाणुओं के बराबर होता है |
♦ मोलर द्रव्यमान :- पदार्थ के एक मोल अणु का द्रव्यमान उसका मोलर द्रव्यमान कहलाता है |
♦ आवोगाद्रों संख्या :- किसी पदार्थ के एक मोल में विधमान कणों जैसे परमाणुओं , अणुओं या आयनों की संख्या को आवोगाद्रों संख्या कहते है इसका मान 6.022 ×10 ²³ प्रति मोल ( 6.022 ×10 ²³ mol‾¹ ) है |
Q1.)निम्न के बीच बन्ने वाले यौगिको का सूत्र और नाम लिखिए _
- पोटेशियम एंव आयोडाइड आयन
- सोडियम एंव सल्फाइड आयन
- एलुमिनियम एंव क्लोराइड आयन
उत्तर:- 1) पोटेशियम आयोडाइड (Kl)
2) सोडियम सल्फाइड (Na2S)
3 ) एलुमिनियम क्लोराइड ( AlCl₃)
Q2.) निम्न आयनों का संयोग से बनने वाला यौगिकों के सूत्र लिखिए |
(1) Cr³+ और F− (2) Hg2+ और S2 (3)Pb2+ और (Po4)3-
उत्तर:- (1) Cr F3 (2) HgS (3) Pb3 (Po4)2
Q3.) निम्नलिखित सूत्रों द्वारा दर्शाए गए यौगिकों का नाम लिखिए _
1) Nis 2) Mg(No3)2 3)K2 So4
उत्तर:- 1) निकेल सल्फाइड 2) मेगनीसियम नाइट्रेट 3) पोटेशियम सल्फेट .
Q4.) निम्निलिखित यौगिकों के सूत्र लिखिए-
1) अमोनियम कार्बोनेट 2) बेरियम सल्फेट 3) कैल्सियम फोस्फेट
उत्तर:-1) (Nh3)2 Co3 (2)BaSo4 (3) Ca(Po4 )2
Q5.) निम्नलिखित यौगिकों के रासायनिक सूत्र लिखिए_
1)सल्फ्यूरिक अम्ल (2) केल्सियम हाइड्रोक्साइड
उत्तर:- H2 SO4 2) Ca(OH)2
Q6.) बहु परमाणुक आयन क्या होते हैं? उदाहरण दीजिए।
उत्तर:- परमाणुओं के समूह जिन पर नेट आवेश विद्यमान है उसे बहुपरमाणुक आयन कहते हैं। जैसे-अमोनियम (NH4)+ ,सल्फेट (SO4)2- आदि।
Q7.) डाल्टन के परमाणु सिद्धान्त का कौन-सा अभिग्रहीत द्रव्यमान के संरक्षण के नियम का परिणाम है?
उत्तर:- डाल्टन के सिद्धान्त का दूसरा अभिग्रहीत “परमाणु अविभाज्य सूक्ष्मतम कण होते हैं जो रासायनिक क्रिया में न तो सृजित होते हैं और ना ही उनका विनाश होता है।”
Q8.) डाल्टन के परमाणु सिद्धान्त का कौन-सा अभिग्रहीत निश्चित अनुपात के नियम की व्याख्या करता है?
उत्तर:- भिन्न-भिन्न तत्वों के परमाणु परस्पर छोटी पूर्ण संख्या के अनुपात में संयोग कर यौगिक निर्मित करते हैं तथा किसी भी यौगिक में परमाणु की सापेक्ष संख्या एवं प्रकार निश्चित होते हैं। परमाणु सिद्धान्त का यह अभिग्रहीत निश्चित अनुपात नियम की व्याख्या करता है।
Q9.)परमाणु द्रव्यमान इकाई को परिभाषित कीजिए।
उत्तर:
1 ) कार्बन – 12 समस्थानिक को मानक सन्दर्भ के रूप में सार्वभौमिक रूप से स्वीकार किया गया था।
2) कार्बन – 12 समस्थानिक के एक परमाणु द्रव्यमान के 1/12 वें भाग को मानक परमाणु द्रव्यमान इकाई कहते हैं।
Q11.) निम्नलिखित में कितने परमाणु विद्यमान हैं?
(i) H2S अणु एवं
(ii) PO4³‾ आयन?
उत्तर:
(i) H2S अणु-इसमें तीन परमाणु (दो परमाणु हाइड्रोजन तथा एक परमाणु सल्फर) विद्यमान हैं।
(ii)PO4³‾ आयन-इसमें पाँच परमाणु (एक परमाणु फॉस्फोरस तथा चार परमाणु ऑक्सीजन के विद्यमान हैं।
Q12.) एक परमाणु को आँखों द्वारा देखना क्यों सम्भव नहीं होता है?
उत्तर: परमाणु का आकार अत्यन्त सूक्ष्म होता है। अतः परमाणु को आँखों द्वारा देखना संभव नहीं है।
Q13.) यदि कार्बन परमाणुओं के एक मोल का द्रव्यमान 12 ग्राम है तो कार्बन के एक परमाणु का द्रव्यमान क्या होगा?
उत्तर :- कार्बन के एक मोल परमाणुओं अर्थात् 6.022 x 10²³ परमाणुओं का द्रव्यमान = 12 ग्राम
अतः कार्बन के 1 परमाणु का द्रव्यमान होगा
= 12/6.022 ²³ग्राम
= 1.99 x 10²³-ग्राम
Q14.) किसमें अधिक परमाणु होंगे – 100g सोडियम अथवा 100g लोहा (Fe)? (Na का परमाणु द्रव्यमान = 23 u Fe का परमाणु द्रव्यमान = 56 u)
उत्तर:- सोडियम (Na) का परमाणु द्रव्यमान = 23 u
सोडियम (Na) का मोलर द्रव्यमान = 23 ग्राम
मोलों की संख्या n = n/M =100g/23g =4.35 मोल
इसी प्रकार Fe के मोलों की संख्या = 100/56= 1.78 मोल
चूँकि सोडियम के मोलों की संख्या, Fe से अधिक है;
अत: Na के 100 ग्राम में अधिक परमाणु हैं।
Q15.) 3.0g कार्बन 8.00g ऑक्सीजन में जलकर 11.00g कार्बन डाइऑक्साइड निर्मित करता है। जब 3.00g कार्बन को 50.00g ऑक्सीजन में जलाएँगे तो कितने ग्राम कार्बन डाइऑक्साइड का निर्माण होगा? आपका उत्तर रासायनिक संयोजन के किस नियम पर आधारित होगा?
उत्तर:- C + O2 → CO2
कार्बन का द्रव्यमान = 3g
ऑक्सीजन का द्रव्यमान = 8g
अभिकारकों का कुल द्रव्यमान = 3 + 8 = 11g
उत्पाद (CO2) का द्रव्यमान = 11 g
अतः अभिकारकों का कुल द्रव्यमान = उत्पाद का कुल द्रव्यमान
प्रश्नानुसार, कार्बन का द्रव्यमान = 3g
ऑक्सीजन का द्रव्यमान = 50g
अभिकारकों का कुल द्रव्यमान = 3 + 50 = 53 g
द्रव्यमान संरक्षण के नियमानुसार
अभिकारकों का कुल द्रव्यमान = उत्पाद का कुल द्रव्यमान
∴ उत्पाद का कुल द्रव्यमान = 53 g
यह रासायनिक संयोग ‘द्रव्यमान संरक्षण नियम’ पर आधारित है।
Q16.) CaCl2 के सूत्र इकाई द्रव्यमान क परिकलन कीजिये ?
उत्तर:- कैल्सियम क्लोराइड का सूत्र इकाई द्रव्यमान CaCl2 है –
कैल्सियम (Ca) का परमाणु द्रव्यमान = 40u
क्लोरिन (Cl) का परमाणु द्रव्यमान = 35.5 u
अत:
CaCl2 का सूत्र इकाई द्रव्यमान =1×40u+ 2 × 35.5 u = 40u+71 u = 111 u
Q17.) निम्नलिखित द्रव्यमानो का परिकलन कीजिये __
1) 0.5 मोल N2 गैस (अणु के मोल से द्रव्यमान)
2) 0.5 मोल N परमाणु (परमाणु के मोल से द्रव्यमान )
3) 3.011 ×10²³ N2 परमाणु की संख्या ( संख्या से द्रव्यमान )
4)6.022 ×10²³ N2अणुओं की संख्या ( संख्या से द्रव्यमान )
उत्तर:- 1) N2 का मोलर द्रव्यमान = 14 × 2 = 28g
दिया गया द्रव्यमान = 0.5 g
द्रव्यमान संख्या = मोलर द्रव्यमान × दिया गया द्रव्यमान
द्रव्यमान संख्या = 28g × 0.5g =14g Ans
2) N का मोलर द्रव्यमान = 14 g
दिया गया द्रव्यमान = 0.5 g
द्रव्यमान संख्या = मोलर द्रव्यमान × दिया गया द्रव्यमान
द्रव्यमान संख्या = 14g ×0.5 g = 7g Ans
3) दिए गये कणों की संख्या = 3.011 ×10²³
N का मोलर द्रव्यमान = 14 g
मोलों की संख्या = दिए गये कणों की संख्या/आवोगाद्रों संख्या
3.011 ×10²³/ 6.022×10²³ = 0.5
मोलों की संख्या = मोलर द्रव्यमान × मोलों की संख्या
मोलों की संख्या = 14 × 0.5 = 7 g Ans
4) N2 का मोलर द्रव्यमान = 14 × 2 = 28g
मोलों की संख्या = दिए गये कणों की संख्या/आवोगाद्रों संख्या
मोलों की संख्या = 6.022×10²³/6.022×10²³ = 1 g
द्रव्यमान संख्या = मोलर द्रव्यमान × मोलों की संख्या
द्रव्यमान संख्या = 28 × 1 = 28 g Ans
Q18.) निम्नलिखित प्रत्येक में कणों की संख्या क परिकलन कीजिये ____
- 46g सोडियम परमाणु ( द्रव्यमान संख्या )
- 8 g ऑक्सीजन अणु (द्रव्यमान से संख्या)
- 0.1 मोल कार्बन परमाणु ( दिए गये मोल से संख्या )
उत्तर :-
1.) दिया गया द्रव्यमान = 46 g
N का मोलर द्रव्यमान = 23 g
द्रव्यमान संख्या = दिया गया द्रव्यमान / मोलर द्रव्यमान × आवोगाद्रो संख्या
द्रव्यमान संख्या = 46 / 23 × 6.022 × 10 ²³
⇒ 12 .044 × 10 ²³ ans
2.) दिया गया द्रव्यमान = 8 g
O₂ का मोलर द्रव्यमान = 16 × 2 = 32 g
अणुओं की संख्या = दिया गया द्रव्यमान / मोलर द्रव्यमान × आवोगाद्रो संख्या
अणुओं की संख्या = 8 / 32 × 6.022 × 10 ²³
⇒ 1.5055 × 10 ²³
≅ 1.51 × 10 ²³ ans
3.) दिया गया मोलों की संख्या = 1.0
कणों की संख्या = मोलो की संख्या × आवोगाद्रो संख्या
कणों की संख्या = 1.0 × 6.022 × 10 ²³
⇒ 6.022 × 10 ²²
Q19.) निम्लिखित में मोलों की संख्या क परिकलन कीजिए__
1) 52 g हीलियम ( द्रव्यमान से मोल प्राप्त कीजिये )
2) 12.044 × 10²³ हीलियम परमाणुओं की संख्या ( कणों की संख्या से मोल प्राप्त कीजिए )
उत्तर:-
हीलियम परमाणुओं की संख्या ( कणों की संख्या से मोल प्राप्त कीजिए )
उत्तर:-
1.) दिया गया द्रव्यमान = 52g
He का मोलर द्रव्यमान = 4u
मोलों की संख्या = दिया गया द्रव्यमान / मोलर द्रव्यमान
⇒ 52 / 4 = 13 Ans.
2.) दिए गये कणों की संख्या = 12.0 44 × 10²³
हम जानते हैं 1 मोल = 6.022 × 10²³
मोलो की संख्या = दिए गये कणों की संख्या / अवोगाद्रों संख्या
⇒ 12.0 44 × 10²³ / 6.022 × 10²³
⇒ 2 Ans.
Q21.)निम्नलिखित यौगिकों के सूत्र इकाई द्रव्यमान का परिकलन कीजिए- ZnO, Na2O एवं K2CO3 दिया गया है-
Zn का परमाणु द्रव्यमान = 65 u,
Na का परमाणु द्रव्यमान = 23 u
K का परमाणु द्रव्यमान = 39 u,
C का परमाणु द्रव्यमान = 12 u एवं
O का परमाणु द्रव्यमान = 16 u है।
उत्तर:-
(i) ZnO का सूत्र इकाई द्रव्यमान =(1 × 65 + 1 × 16) u
= (65 + 16) u
= 81u
(ii) Na2O का सूत्र इकाई द्रव्यमान
=(2 × 23 + 1 × 16) u
= (46 + 16) u = 62 u
(iii) K2CO3 का सूत्र इकाई द्रव्यमान
= (2 × 39 + 1 × 12 + 3 x 16 ) u
= (78 + 12 + 48) u
= 138 u
Q22.)निम्नलिखित यौगिकों के आण्विक द्रव्यमान का परिकलन कीजिए-H2, O2, Cl2, CO2, CH4, C2H6, C2H4, NH3 एवं CH3OH
हल:
- H2 का आण्विक द्रव्यमान = 2 x 1 = 2 u
- O2 का आण्विक द्रव्यमान = 2 x 16 = 32 u
- Cl2 का आण्विक द्रव्यमान = 2 x 35.5 = 71 u
- CO2 का आण्विक द्रव्यमान = 1 x 12 + 2 x 16 = 44 u
- CH4 का आण्विक द्रव्यमान = 1 x 12 + 4 x 1 = 16 u
- C2H6 का आण्विक द्रव्यमान = 2 x 12 + 6 + 1 = 30 u
- NH3 का आण्विक द्रव्यमान = 2 x 12 + 4 x 1 = 28 u
- CH3OH का आण्विक द्रव्यमान = 1 x 12 + 3 x 1 + 1 x 16 + 1 x 1 = 32 u
Q23.) निम्न के सूत्र लिखिए :
- हाइड्रोजन क्लोराइड
- कार्बन टेट्राक्लोराइड
- एलुमिनियम ऑक्साइड
- कैल्सियम ऑक्साइड
उत्तर:-
1) HCl
2.) CCl4
3.) Al2O3
4.) CaO
Q20.) मोल ,अवोगाद्रो संख्या एंव द्रव्यमान के बीच सम्बन्ध __
उत्तर:-